EJERCICIOS DE LABORATORIO
ALCOHOLES I, II
MICHELLE JULIANA SANDOVAL ARIZA
ONCE -3
CÓDIGO 22
DIANA FERNANDA JARAMILLO
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
2019
INTRODUCCIÓN
En este blog encontraremos ejercicios sobre el tema de loa alcoholes , en la practica se elige el nombre que cree correspondiente al compuesto y a sus sustituyentes correspondientes teniendo en cuenta el lugar en donde están ubicados.
OBJETIVOS
- investigar información sobre la química orgánica en especial de los alcoholes.
- comprender las ventajas y desventajas que presentan estos compuestos.
- analizar sus propiedades y concluir su importancia.
- comprar la reactividad de los alcoholes alifáticos con las de los fenoles, en presencia de diferentes reactivos.
- ALCOHOLES
- . Los alcoholes son un grupo de moléculas orgánicas caracterizadas por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.Los alcoholes son compuesto orgánicos que contienen el grupo hidroxilo (-OH). El metanol es el alcohol más sencillo, se obtiene por reducción del monóxido de carbono con hidrógeno.
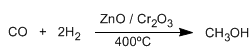
- Los alcoholes son una serie de compuestos que poseen un grupo hidroxilo, -OH, unido a una cadena carbonada; este grupo OH está unido en forma covalente a un carbono con hibridación. Cuando un grupo se encuentra unido directamente a un anillo aromático, los compuestos formados se llaman fenoles y sus propiedades químicas son muy diferentes.
En el laboratorio los alcoholes son quizá el grupo de compuestos más empleado como reactivos en síntesis.
- Los alcoholes tienen uno, dos o tres grupos hidróxido (-OH) enlazados a sus moléculas, por lo que se clasifican en monohidroxílicos, dihidroxílicos y trihidroxílicos respectivamente. El metanol y el etanol son alcoholes monohidroxílicos. Los alcoholes también se pueden clasificar en primarios, secundarios y terciarios, dependiendo de que tengan uno, dos o tres átomos de carbono enlazados con el átomo de carbono al que se encuentra unido el grupo hidróxido. Los alcoholes se caracterizan por la gran variedad de reacciones en las que intervienen; una de las más importantes es la reacción con los ácidos, en la que se forman sustancias llamadas ésteres, semejantes a las sales inorgánicas. Los alcoholes son subproductos normales de la digestión y de los procesos químicos en el interior de las células, y se encuentran en los tejidos y fluidos de animales y plantas.
Los alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no saturados.
Alcoholes primarios, secundarios y terciarios.
Un alcohol es primario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) primario:
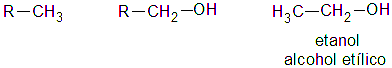
Es secundario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario:
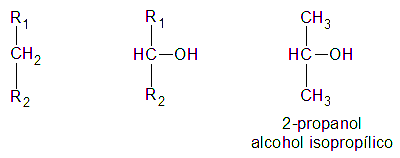
Finalmente, es terciario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) terciario:
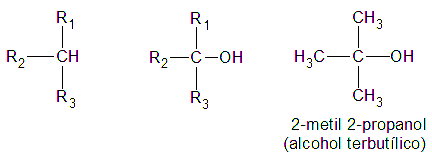
La función alcohol puede repetirse en la misma molécula, resultando monoles, o alcoholes monovalentes; dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes, etc.
PROPIEDADES QUÍMICAS DE LOS ALCOHOLES.
Reacciones del -H de hidroxilo por ruptura del enlace.
Técnica. Un trocito de sodio del tamaño de un guisante se echa sobre 5 ml de alcohol etílico puesto en un tubo de ensayos. Cuando la reacción se ha completado, se añade un volumen igual de éter anhidro y se observa el resultado. A continuación se vierte la mezcla en un vidrio de reloj y se deja evaporar el éter y el exceso de alcohol etílico..
Interpretación

Formación de alcoholatos.
Reaccionan con los metales alcalinos como como el Li, Na, K... y aún con los alcalino-térreos como el Ca. El hidrógeno del hidroxilo es reemplazado por el metal desprendiéndose en estado gaseoso.

La sustancia que se forma es un alcóxido o alcoholato que en este caso se denomina etanolato o etóxido de sodio.
El alcohol en estas reacciones actúa como un ácido débil.
Como los alcanos no reaccionan con los metales alcalinos, debe admitirse que el átomo reemplazado es el de hidrógeno unido al hidroxilo, lo que prueba la polarización de la molécula de los alcoholes.
La reacción de los alcoholes con los metales alcalinos es menos enérgica que la de éstos con el agua.
La acidez de los alcoholes varía ampliamente, desde los alcoholes que son casi tan ácidos como el agua. Hasta algunos que son mucho menos ácidos. La constante de disociación ácida, Ka, de un alcohol, queda definida por el equilibrio siguiente:

Los alcoholes más ácidos, como el etanol y el metanol, reaccionan rápidamente con sodio para formar metóxido y etóxido de sodio. Los alcoholes secundarios, como el 2-butanol, reaccionan con velocidad más moderada. Los alcoholes terciarios, como el alcohol t-butílico, reaccionan lentamente. Con los alcoholes terciarios con frecuencia se usa el potasio, K, porque es más reactivo que el sodio y la reacción puede completarse en un tiempo razonable.

Reacciones por sustitución del grupo hidroxilo.Formación de esteres inorgánicos.
Cuando se efectúa la reacción entre un alcohol y un ácido inorgánico se produce un éster inorgánico.
En estos casos el agua se forma entre el -OH del alcohol y el protón del ácido

Otro ejemplo es la reacción del ácido clorhídrico con alcoholes secundarios y terciarios. El alcohol ter-butílico reacciona para dar un 98 % de cloruro de ter-butilo.
Reactivo. El reactivo formado por HCl y ZnCl2 se llama reactivo de Lucas. Los alcoholes secundarios y terciarios reaccionan generalmente con el reactivo de Lucas por un mecanismo SN1.Preparación. Disolver 68 g (0,5 ml) de cloruro de zinc anhidro en 52,5 g de ácido clorhídrico concentrado, enfriando para evitar pérdidas del ácido. Técnica. Colocar 1 ml del alcohol en un tubo de ensayos y agregar 6 ml de reactivo de Lucas. Tapar y dejar reposar durante 5 minutos.
Oxidación de los alcoholes.
Con permanganato a distintos valores de pH. Se han desarrollado muchos métodos para la oxidación de alcoholes. Por ejemplo, con frecuencia se emplea el permanganato de potasio como alternativa más económica en comparación con los oxidantes de cromo. El permanganato oxida a los alcoholes secundarios llegando a la cetona, los alcoholes primarios a ácidos carboxílicos.

El reactivo de Jones, que es una solución diluida de ácido crómico en acetona, es más suave que el reactivo normal de ácido crómico.
FENOLES
Los fenoles son derivados de los alcoholes, son muy solubles en agua y en la mayoría de los disolventes orgánicos. Son altamente tóxicos para el ser humano y su contacto puede provocar la muerte.Los fenoles no siguen ninguna regla fija de nomenclatura, los más simples sin embargo, pueden ser nombrados utilizando el anillo aromático como cadena principal y los grupos ligados a él como radicales.
La reacción del fenol con el ácido sulfúrico, es para la obtención del ácido hidroxibencensulfónico:
C6H5 - OH + H2SO4 C6H4 (SO3H) - OH + H2O.
La nitración del fenol, se lleva a cabo con el ácido nítrico diluido, el producto final, es el 2- 4- 6- trinitrofenol, o sea, el explosivo ácido pícrico:
C6H5 - OH + 3HNO3 C6H2 (NO2)3OH + 3H2O
Por oxidación forma el ácido oxálico y productos resinosos. La reacción más importante del fenol, es su condensación con el formaldehído, contándose con el 60% de la producción del fenol en los EEUU., para la obtención de las llamadas resinas fenólicas:
C6H5 - OH + 3HCHO C6H2 - OH - (CH2OH)3
C6H2 - OH (CH2OH)3 [ C6H2 - OH - (CH2O+)] - 3
La condensación del fenol y la acetona, den el 4- 4` isopropilidendifenol o bisfenol A. La condensación del fenol con el anhídrido ftálico a la fenolftaleína; su reacción con el fenato de sodio y el bióxido de carbono, para formar el ácido salicílico.
También es de importancia comercial el acoplamiento del fenol con las sales de diazonio, para la obtención de tinturas azo.
El fenol, sirve como materia prima para obtener la E Caprolactama, que a su vez es la materia prima para la obtención del Nylon 6, por medio de las siguientes reacciones.
1. Deshidrogenación del fenol a ciclohexano:
C6H5OH + 3H2 C6H11 - OH
2. Deshidrogenación a ciclohexanona:
2C6H11 - OH 2 (C6H10 = O) + H2
3. Conservación de esta ciclohexanol a ciclohexanona oxima, por la reacción de aquella con la hidroxilamina y en presencia de un catalizador de ácido sulfúrico:
C6H10 = O + NH2 OH H2O + C6H10 = NOH
El fenol se utiliza para la preparación de resinas sintéticas, medicamentos, plaguicidas, colorantes sintéticos, sustancias aromáticas, aceites lubricantes, solventes entre muchos otros
Los fenoles son compuestos orgánicos que resultan de sustituir átomos de hidrógeno del núcleo bencénico por el grupo hidroxilo (-OH). Su fórmula general es Ar– OH, donde Ar significaradical bencénico o grupo aromático. Son compuestos diferentes a los alcoholes, a pesar que ambos poseen el grupo funcional hidroxilo.
EJERCICIOS
VIDEO : https://youtu.be/CKq1eUZhLoE
WEBGRAFIA













NO HAY INTRODUCCIÓN NI OBJETIVOS Y EL MARCO TEÓRICO MUY POBRE SIN REGLAS DE NOMENCLATURA 3,7
ResponderEliminar