COMPUESTOS ORGÁNICOS
GRUPO ( 4, 5, 6, 7 )
MICHELLE JULIANA SANDOVAL ARIZA
ONCE- TRES
DOCENTE: DIANA JARAMILLO
INTRODUCCIÓN
Los compuestos orgánicos son complejos y responsables en particular de las propiedades celulares de la vida. Todos los compuestos orgánicos comparten la característica de poseer un bioelemento base, llamado "
CARBONO" en sus moléculas. Esto se debe a que el carbono se une muy fácilmente entre sí,desarrollando estructuras básicas en todos los compuestos orgánicos. Estas cadenas pueden presentar distintas longitudes y formas. A estas cadenas también se le pueden asociar otros átomos de gran importancia como por ejemplo:Hidrógeno (H) - Oxígeno (O) - Nitrógeno (N) - Fósforo (P) - Azufre (S)Cada átomo de carbono presenta una valencia de 4, lo que aumenta significativamente la complejidad de los compuestos que pueden formar; teniendola posibilidad de dobles o triples enlaces, aumentando de esta manera la variabilidad de las estructuras y configuración de los compuestos orgánicos.
OBJETIVOS
1. Reconocer las diferentes estructuras de las moléculas orgánicas para interpretar su reactividad y propiedades.
2. conocer productos que utilizamos a diario que tienen estos compuestos
3. ayudar a mejorar el conocimiento que se tiene de esto
4. manejar el adecuado vocabulario de cada uno de los compuestos
¿QUE SON LOS COMPUESTOS ORGÁNICOS?
Compuesto orgánico. Sustancias químicas que contienen carbono, formando enlaces covalentes carbono-carbono y/o carbono-hidrógeno. En muchos casos contienen oxígeno, y también nitrógeno, azufre, fósforo,boro, halógenos y otros elementos. Estos compuestos se denominan moléculas orgánicas. No son moléculas orgánicas los compuestos que contienen carburos, los carbonatos y los óxidos de carbono.
No son moléculas
orgánicas los compuestos que contienen carburos, los carbonatos y los óxidos de
carbono. La principal característica de estas sustancias es que arden y pueden
ser quemadas (son compuestos combustibles). La mayoría de los compuestos orgánicos
se producen de forma artificial, aunque solo un conjunto todavía se extrae de
forma natural.
Las moléculas
orgánicas pueden ser de dos tipos
- Moléculas
orgánicas naturales: son las sintetizadas por los seres vivos, y se llaman
biomoléculas, las cuales son estudiadas por la bioquímica
- Moléculas orgánicas artificiales: son sustancias que no existen en la
naturaleza y han sido fabricadas por el hombre como los plásticos.
La línea que divide las moléculas orgánicas de las inorgánicas ha originado
polémicas e históricamente ha sido arbitraria, pero generalmente, los
compuestos orgánicos tienen carbono con enlaces de hidrógeno, y los compuestos
inorgánicos, no. Así el ácido carbónico es inorgánico, mientras que el ácido
fórmico, el primer ácido graso, es orgánico. El anhídrido carbónico y el
monóxido de carbono, son compuestos inorgánicos. Por lo tanto, todas las
moléculas orgánicas contienen carbono, pero no todas las moléculas que
contienen carbono, son moléculas orgánicas.
Historia
La etimología
de la palabra «orgánico» significa que procede de órganos, relacionado con la
vida; en oposición a «inorgánico», que sería el calificativo asignado a todo lo
que carece de vida. Se les dio el nombre de orgánicos en el siglo XIX, por la
creencia de que sólo podrían ser sintetizados por organismos vivos. La teoría
de que los compuestos orgánicos eran fundamentalmente diferentes de los
"inorgánicos", fue refutada con la síntesis de la urea, un compuesto
"orgánico" por definición ya que se encuentra en la orina de organismos
vivos, síntesis realizada a partir de cianato de potasio y sulfato de amonio
por Friedrich Wöhler (síntesis de Wöhler). Los compuestos del carbono que
todavía se consideran inorgánicos son los que ya lo eran antes del tiempo de
Wöhler; es decir, los que se encontraron a partir de fuentes sin vida,
"inorgánicas", tales como minerales.
CARACTERÍSTICAS DE LOS COMPUESTOS ORGÁNICOS
Todos los compuestos orgánicos utilizan como base de construcción al átomo de carbono y unos pocos elementos más, mientras que en los compuestos inorgánicos participan la gran mayoría de los elementos conocidos.-En su origen los compuestos inorgánicos se forman ordinariamente por la acción de las fuerzas fisicoquímicas: fusión, sublimación, difusión, electrolisis y reacciones químicas a diversas temperaturas. La energía solar, el oxígeno, el agua y el silicio han sido los principales agentes en la formación de estas sustancias.
-Las sustancias orgánicas se forman naturalmente en los vegetales y animales pero principalmente en los primeros, mediante la acción de los rayos ultravioleta durante el proceso de la fotosíntesis: el gas carbónico y el oxígeno tomados de la atmósfera y el agua, el amoníaco, los nitratos, los nitritos y fosfatos absorbidos del suelo se transforman en azúcares, alcoholes, ácidos, ésteres, grasas, aminoácidos, proteínas, etc., que luego por reacciones de combinación, hidrólisis y polimerización entre otras, dan lugar a estructuras más complicadas y variadas.
Se forman a base de carbono.- Los compuestos
orgánicos tienen estructuras carbonadas, es decir, los distintos compuestos que
forman las estructuras de los diversos organismos conocidos, contienen carbono
dentro de sus estructuras moleculares. Esto se debe principalmente a la
cualidad del carbono para formar enlaces y combinarse con otros elementos,
debido a que cada uno de sus átomos puede compartir hasta cuatro electrones con
otros átomos, pudiéndose enlazar en largas cadenas, que pueden ser lineales,
ramificadas, o formar anillos, formándose así gran variedad de estructuras
moleculares, con diversas propiedades. Al estar compuestas de carbono todas las
estructuras orgánicas que se conocen, se dice que la vida sólo es posible en la
presencia de carbono, ya que es gracias a sus características que se pueden
formar millones de combinaciones con otros átomos de carbono y de otros
elementos, por lo que la vida está fundamentada o basada en el carbono. Algunos
de los compuestos orgánicos indispensables para la vida animal y vegetal, son
los carbohidratos, lípidos, ácidos nucleicos y proteínas.
Algunos
son Isómeros.- Varios compuestos orgánicos presentan isomería, (la isomería
es la propiedad de algunos compuestos de poseer fórmulas iguales en la
proporción de elementos de los que se forma la molécula, pero que presentan
estructuras moleculares distintas y por ende propiedades diferentes). Un
ejemplo de isómeros orgánicos son el alcohol etílico y el éter dimetílico, que
se componen de la misma cantidad de elementos pero que están organizados en
estructuras diferentes, de la misma manera sucede con varios azúcares.
TIPOS DE MOLÉCULAS ORGÁNICAS
Moléculas orgánicas naturales
Son las sintetizadas por los seres vivos, y se llaman biomoléculas, las cuales son estudiadas por la bioquímica.
Moléculas orgánicas artificiales
Son sustancias que no existen en la naturaleza y han sido fabricadas por el hombre como los plásticos. La línea que divide las moléculas orgánicas de las inorgánicas ha originado polémicas e históricamente ha sido arbitraria, pero generalmente, los compuestos orgánicos tienen carbono con enlaces de hidrógeno, y los compuestos inorgánicos, no. Así el ácido carbónico es inorgánico, mientras que el ácido fórmico, el primer ácido graso, es orgánico. El anhídrido carbónico y el monóxido de carbono, son compuestos inorgánicos. Por lo tanto, todas las moléculas orgánicas contienen carbono, pero no todas las moléculas que contienen carbono, son moléculas orgánicas.
Lípidos:Están compuestas principalmente por carbono
e hidrógeno y en menor medida oxígeno, aunque también pueden contener fósforo,
azufre y nitrógeno. No responden a una estructura química común y sus
propiedades biológicas son muy variadas, si bien tienen como característica
principal el ser hidrofóbas o insolubles en agua y sí en solventes orgánicos
como la bencina, el alcohol, el benceno y el cloroformo. En el uso coloquial, a
los lípidos se les llama incorrectamente grasas, ya que las grasas son sólo un
tipo de lípidos procedentes de animales. Los lípidos cumplen funciones diversas
en los organismos vivientes, entre ellas la de reserva energética
(triglicéridos), la estructural (fosfolípidos) .
Los ácidos nucleicos tienen una enorme importancia, ya que son los
responsables de la biosíntesis de las proteínas. Existen dos tipos de ácidos
nucleicos: el ácido ribonucleico (ARN) y el ácido desoxirribonucleico
(ADN).
Vitaminas: son compuestos orgánicos (es decir compuestos que contienen al menos un átomo de carbono) que cumplen diversas funciones en nuestro organismo. Todavía no sabemos la totalidad de las funciones de las vitaminas en nuestro cuerpo. Sin embargo, sabemos que algunas de estas tienen que ver con el metabolismo. Otras con la manufactura de hormonas, neurotransmisores del sistema nervioso, células de la sangre y material genético. Muchas veces las vitaminas actúan acelerando las reacciones químicas normales del organismo. Reacciones que sin la presencia de las vitaminas no se producirían o de producirse se llevarían a cabo demasiado lentamente para servir de apoyo a la vida. La casi totalidad de las vitaminas deben obtenerse a través de la alimentación ya que el cuerpo humano no las produce
Vitaminas: son compuestos orgánicos (es decir compuestos que contienen al menos un átomo de carbono) que cumplen diversas funciones en nuestro organismo. Todavía no sabemos la totalidad de las funciones de las vitaminas en nuestro cuerpo. Sin embargo, sabemos que algunas de estas tienen que ver con el metabolismo. Otras con la manufactura de hormonas, neurotransmisores del sistema nervioso, células de la sangre y material genético. Muchas veces las vitaminas actúan acelerando las reacciones químicas normales del organismo. Reacciones que sin la presencia de las vitaminas no se producirían o de producirse se llevarían a cabo demasiado lentamente para servir de apoyo a la vida. La casi totalidad de las vitaminas deben obtenerse a través de la alimentación ya que el cuerpo humano no las produce
VIDEO :
CARBONO
(COMPUESTO ORGÁNICO )
El carbono es único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados.
Con mucho, el grupo más grande de estos compuestos es el constituido por carbono e hidrógeno. Se estima que se conoce un mínimo de 1.000.000 de compuestos orgánicos y este número crece rápidamente cada año. Aunque la clasificación no es rigurosa, el carbono forma otra serie de compuestos considerados como inorgánicos, en un número mucho menor al de los orgánicos.
El carbono elemental existe en dos formas alotrópicas cristalinas bien definidas: diamante y grafito. Otras formas con poca cristalinidad son carbón vegetal, coque y negro de humo. El carbono químicamente puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia de aire. Las propiedades físicas y químicas del carbono dependen de la estructura cristalina del elemento. La densidad fluctúa entre 2.25 g/cm³ (1.30 onzas/in³) para el grafito y 3.51 g/cm³ (2.03 onzas/in³) para el diamante. El punto de fusión del grafito es de 3500ºC (6332ºF) y el de ebullición extrapolado es de 4830ºC (8726ºF). El carbono elemental es una sustancia inerte, insoluble en agua, ácidos y bases diluidos, así como disolventes orgánicos. A temperaturas elevadas se combina con el oxígeno para formar monóxido o dióxido de carbono.
Los compuestos orgánicos son complejos y responsables en
particular de las propiedades celulares de la vida. Todos los compuestos
orgánicos comparten la característica de poseer un bioelemento base, llamado
"CARBONO" en sus moléculas. Esto se debe a que el carbono se une muy
fácilmente entre sí, desarrollando estructuras básicas en todos los compuestos
orgánicos. Estas cadenas pueden presentar distintas longitudes y formas. A
estas cadenas también se le pueden asociar otros átomos de gran importancia
como por ejemplo: Hidrógeno (H) - Oxígeno (O) - Nitrógeno (N) - Fósforo (P) -
Azufre (S)Cada átomo de carbono presenta una valencia de 4, lo que aumenta
significativamente la complejidad de los compuestos que pueden formar; teniendo
la posibilidad de dobles o triples enlaces, aumentando de esta manera la
variabilidad de las estructuras y configuración de los compuestos orgánicos.
Con agentes oxidantes calientes, como ácido nítrico y nitrato de potasio, se obtiene ácido melítico C6(CO2H)6. De los halógenos sólo el flúor reacciona con el carbono elemental. Un gran número de metales se combinan con el elemento a temperaturas elevadas para formar carburos.
Hidrocarburos
Radicales y ramificaciones de cadena
Un compuesto que se encuentra mayoritariamente en los seres vivos es conocido como un compuesto orgánico . Los compuestos orgánicos componen a las células y otras estructuras de los organismos y llevan a cabo procesos de vida. El carbono es el elemento principal en los compuestos orgánicos, así que el carbono es esencial para la vida en la Tierra. Sin carbono, la vida como la conocemos no existiría.
Compuestos
Un compuesto es una sustancia que consiste de dos o más elementos. Este tiene una composición única que no varía. La partícula más pequeña de un compuesto se llama molécula. Considera el agua como un ejemplo. Una molécula de agua siempre contiene un átomo de oxígeno y dos de hidrógeno. La composición del agua se expresa por la fórmula química H 2 O. . se muestra un modelo de una molécula de agua. El agua no es un compuesto orgánico.
carbono para formar enlaces estables
para con muchos elementos, incluyéndose a sí mismo. Esta propiedad le permite
formar al carbono una gran variedad de moléculas muy grandes y complejas. De
hecho, ¡hay casi 10 millones de compuestos a base de carbón en los seres vivos!
Sin embargo, los millones de compuestos orgánicos pueden agruparse en solo
cuatro tipos principales: carbohidratos , lípidos , proteínas y ácidos nucleicos .
Puede que se vea como un deshecho, pero
algunas personas lo ven como poder verde. Descubre cómo las granjas lecheras y
los restaurantes de mantel blanco de California están tomando sus sobras y
transformándolas en energía limpia.
- El carbono es el elemento
orgánico principal de los compuestos. Este puede formar enlaces estables
con muchos elementos, incluyéndose a sí mismo.
- Hay cuatro tipos principales
de compuestos orgánicos: carbohidratos, lípidos, proteínas y ácidos nucleicos.
El carbono es un
elemento químico fundamental en los seres vivos. Su número atómico es 6 y su
número másico es 12. En la naturaleza se presenta en forma de grafito y de
diamante. Su valencia o capacidad de combinación es 4, es decir, tetravalente.
Esta capacidad de combinación la presenta también con otros átomos de carbono,
lo que da lugar a las cadenas carbonadas. Estos enlaces carbono-carbono de
carácter covalente pueden dar lugar a moléculas con cadenas abiertas o
cerradas, con sus correspondientes ramificaciones.
Los
compuestos a los que da lugar el carbono pueden agruparse en:
·
Acíclicos: son
compuestos de cadena abierta. Cada átomo de carbono de estas cadenas se
caracteriza por el número de átomos de carbono a que va unido, denominándose primario,
secundario o terciario según esté unido a 1, 2 o 3 átomos de carbono.
·
Cíclicos: son
compuestos de cadena cerrada. Si el ciclo sólo lo forman átomos de carbono, la
serie se llama carbocíclica, y si éstos se combinan con otro tipo
de átomos (oxígeno, nitrógeno, azufre), se llama heterocíclica. Si
el compuesto tiene más de un ciclo en sus estructuras, se llama policíclico.
·
Aromáticos: son
una amplísima y muy importante serie de compuestos derivados del benceno.
El
estudio sistemático de los compuestos orgánicos se hace considerando las
propiedades comunes derivadas de la existencia de un elemento o grupo de átomos
en la molécula llamado grupo funcional.
·
Se
llama función orgánica a las propiedades características de un
grupo de sustancias que las diferencian del resto.
·
Se
denomina grupo funcional al átomo o conjunto de átomos que
confieren a la molécula unas propiedades típicas determinadas
·
Serie homóloga es
el conjunto de compuestos que tienen el mismo grupo funcional y se diferencian
en el número de átomos de carbono.
·
Fórmula molecular y fórmula estructural: la fórmula molecular indica
el número de átomos que hay en la molécula o unidad estructural de la misma. El
conocimiento de la fórmula molecular no define del todo a la sustancia. De
hecho, la diferente unión entre los átomos y la distinta distribución
estructural y espacial reflejan la existencia de distintas sustancias con igual
fórmula molecular y con distinta distribución estructural de los átomos y de
los enlaces entre los mismos.
Hidrocarburos
los hidrocarburos son
compuestos químicos formados por átomos de carbono (C) y de Hidrógeno (H). El
compuesto más simple es el metano, un átomo de carbono con cuatro de hidrógeno (valencia
= 1), pero también puede darse la unión carbono-carbono, formando cadenas de
distintos tipos, ya que pueden darse enlaces simples, dobles o triples. Cuando
el resto de los enlaces de estas cadenas son con hidrógeno, se habla de hidrocarburos,
que pueden ser:
·
Saturados: con enlaces covalentes
simples, alcanos.
·
Insaturados, con dobles enlaces covalentes
(alquenos)
o triples (alquinos).
·
Hidrocarburos : Hidrocarburos saturados con cadena cerrada,
como el ciclohexano.
·
Aromáticos: estructura cíclica.
Radicales y ramificaciones de cadena
Los
radicales o grupos alquilo son fragmentos de cadenas
de carbonos que cuelgan de la cadena
principal. Su nomenclatura se hace con la raíz correspondiente (en
el caso de un carbono met-, dos carbonos et-, tres carbonos prop-, cuatro
carbonos but-, cinco carbonos pent-, seis carbonos hex-, y así
sucesivamente...) y el sufijo -il. Además, se indica con un número, colocado
delante, la posición que ocupan. El compuesto más simple que se puede hacer con
radicales es el metilpropano.
En caso de que haya más de un radical, se nombrarán por orden alfabético de las
raíces. Por ejemplo, el 5-metil,
2-etil, 8-butil, 10-docoseno.
== Clasificación según los
grupos funcionales ==no Los compuestos orgánicos también pueden contener otros
elementos, también otros grupos de átomos además del carbono e hidrógeno,
llamados grupos funcionales. Un ejemplo es el grupo
hidroxilo, que forma los alcoholes: un átomo de oxígeno enlazado a uno de hidrógeno
(-OH), al que le queda una valencia libre. Asimismo también existen
funciones alqueno (dobles
enlaces), éteres, ésteres, aldehídos, cetonas, carboxílicos, carbamoilos, azo, nitro o sulfóxido,
entre otros.
 VIDEO
VIDEO
https://www.youtube.com/watch?v=k9HVNXELTs4 2
NITROGENOS
(COMPUESTO ORGÁNICO )
se encuentran formando parte de los aminoácidos que conforman las proteínas. Cuando la carne de aves y res o el pescado no es preservada en refrigeración, los microorganismos presentes en ella degradan las proteínas en aminas, las que emiten un olor desagradable.

Los compuestos orgánicos nitrogenados: aminas, amidas, nitrilos, y nitrocompuestos, presentan cada uno propiedades específicas, determinadas por la presencia de varios grupos funcionales nitrogenados, gracias a la capacidad que tiene el nitrógeno de formar enlaces sencillos, dobles y triples con los átomos de carbono.
Nitrógeno químicamente ligado en moléculas orgánicas tal
como proteínas, aminas y aminoácidos. a aplicación comercial más importante del
nitrógeno diatómico es la obtención de amoníaco por el proceso de Haber. El
amoníaco se emplea con posterioridad en la fabricación de fertilizantes y ácido
nítrico. Las sales del ácido nítrico incluyen importantes compuestos como el
nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el
nitrato de amonio fertilizante. Los compuestos orgánicos de nitrógeno como la
nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus
derivados se usan como combustible en cohetes.
El ciclo de este elemento es bastante más complejo que el
del carbono, dado que está presente en la atmósfera no sólo como N2 (78%) sino
también en una gran diversidad de compuestos. Se puede encontrar principalmente
como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con
oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los
ácidos nitroso y nítrico.
Nitrógeno químicamente ligado en moléculas orgánicas tal
como proteínas, aminas y aminoácidos. a aplicación comercial más importante del
nitrógeno diatómico es la obtención de amoníaco por el proceso de Haber. El
amoníaco se emplea con posterioridad en la fabricación de fertilizantes y ácido
nítrico. Las sales del ácido nítrico incluyen importantes compuestos como el
nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el
nitrato de amonio fertilizante. Los compuestos orgánicos de nitrógeno como la
nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus
derivados se usan como combustible en cohetes.
El ciclo de este elemento es bastante más complejo que el
del carbono, dado que está presente en la atmósfera no sólo como N2 (78%) sino
también en una gran diversidad de compuestos. Se puede encontrar principalmente
como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con
oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los
ácidos nitroso y nítrico.
Las aminas, son compuestos orgánicos nitrogenados derivados del amoníaco (NH3)
y al igual que éste, tienen una estructura piramidal con tres enlaces (sp3)-s
y un par de electrones no enlazantes.
Según se sustituyan del amoníaco uno, dos o tres átomos de hidrógenos y la naturaleza
de la cadena carbonada se pueden obtener diferentes aminas.
Las
aminas son compuestos orgánicos nitrogenados que resultan de la sustitución de
un átomo de hidrógeno del amoníaco (NH3) por uno o más grupos
alquilo.
Las aminas se encuentran en la naturaleza como parte de los alcaloides, que son compuestos
complejos que se encuentran en las plantas, algunos de ellos son la morfina y
la nicotina o en los aminoácidos QUI-V-020404-01 que conforman las proteínas,
degradan, se descomponen en distintas aminas como la cadaverina y putrescina,
componente esencial del organismo de los seres vivos. Cuando las proteínas se
entre otras.
Las aminas según la cantidad de hidrógenos que hayan sido
sustituidos en la molécula de amoníaco se clasifican en:
Muchas de las aminas esenciales en los seres vivos existen como
sales de aminas y no como aminas. Uno de estos compuestos es el neurotransmisor
acetilcolina, la cual se libera en el extremo de un nervio, viaja a través de
la brecha sináptica, se une a otro miembro y origina un impulso nervioso.
Las estructuras que se derivan de la sustitución paulatina de los átomos de
hidrógeno en la molécula de amoníaco, determinan las manifestaciones de las
propiedades de las aminas.
La estructura resultante de la amina derivada de la sustitución de uno o más
átomos de hidrógeno de la molécula de amoníaco, determina las propiedades y
aplicaciones que éstas presentan, así por ejemplo se explica la diferencia en
la basicidad de una amina primaria, secundaria y terciaria.


Saber hacer:
Carácter ácido base de aminas
Entre las principales propiedades de las aminas está su olor, polaridad, solubilidad,
arder en presencia del oxígeno del aire, su comportamiento como base y su
reacción con los ácidos, halogenuros de alquilo y el ácido nitroso
Sabias que las diaminas putrescina y cadaverina son las responsables del olor
desagradable cuando la carne de aves, pescado y res no es preservada mediante
refrigeración. La putrescina es una molécula orgánica de fórmula NH2(CH2)4NH2 (1,4-diaminobutano,
tetrametilenodiamina o butanodiamina) y la cadaverina NH2(CH2)5NH2,
también conocida como 1,5-diaminopentano, pentametilenodiamina,
pentano-1,5-diamina es una diamina biogénica Ambas se forman por la descomposición de los aminoácidos en organismos vivos y muertos, y pueden representarse también de la forma siguiente
Las
propiedades de las aminas determinan que estas posean diversos usos, por
ejemplo: la fabricación de plásticos mediante polimerización, sirven como
compuestos base para la fabricación de explosivos, la fenilamina es ampliamente
utilizada como colorante, así como la hexametildiamina que se emplea en la
fabricación de nailon.
También se utilizan en las industrias de cosméticos y textiles por el uso o aplicación
que tienen algunos de sus compuestos y derivados en composiciones para teñir el
pelo y como antioxidantes para el caucho.
tenerse en cuenta las siguientes normas:
Identificar la cadena principal como aquella que contiene mayor número de
átomos de carbono y además contiene el grupo amino, lo que determina el nombre
de la raíz.
Colocar la terminación amina al final del nombre del hidrocarburo que
constituye el esqueleto de la cadena principal
Para localizar el grupo amino dentro de la cadena principal se utiliza el
número del carbono que está unido directamente al nitrógeno y este número o
localizador se coloca delante del nombre de la terminación amina.
Si la amina es secundaria o terciaria, se dan los nombres de los radicales
alquilo que están unidos al nitrógeno precedidos de la letra N en cursiva para
indicar que dichos grupos están unidos al nitrógeno y no a un carbono
Para nombrar y formular las aminas de forma trivial se siguen las siguientes normas:
Las aminas se nombran sustituyendo la terminación –o del alcano por –amina.
En las aminas secundarias y terciarias, si un radical se repite se utilizan los
prefijos "di-" o "tri-", si los radicales son diferentes se
nombran en orden alfabético.
Los grupos sustituyentes R, R¢ R² pueden ser iguales o diferentes.
Cuando en las aminas primarias el grupo amino no forma parte de la cadena
principal se nombra como sustituyente de la cadena carbonada con su
correspondiente número localizador y el prefijo "amino.
VIDEO
https://youtu.be/DQRxkgkrW3Q
https://youtu.be/DQRxkgkrW3Q
OXIGENO
( compuesto orgánico )
Los compuestos orgánicos oxigenados se utilizan en diversos campos de la vida moderna, constituyen materia prima para la síntesis de otros compuestos.
Los compuestos oxigenados de los hidrocarburos se emplean en la industria, en la fabricación de medicamentos, como disolventes, plásticos, pintura, como combustible doméstico, entre otros. Dentro de estos compuestos se encuentra el etanol y la acetona, los cuales seguramente conoces, el primero es muy utilizado en la fabricación de licores y rones, y el segundo en quita esmaltes de uñas.
Los compuestos orgánicos oxigenados además de carbono e hidrógeno contienen oxígeno. Dentro de los principales se distinguen los alcoholes, éteres, aldehídos, cetonas, ácidos y ésteres.
PROPIEDADES DEL COMPUESTO ORGÁNICO OXIGENO
En general, los compuestos orgánicos covalentes se distinguen de los compuestos inorgánicos en que tienen puntos de fusión y ebullición más bajos. Por ejemplo, el compuesto iónico cloruro de sodio (NaCl) tiene un punto de fusión de unos 800 °C, pero el tetracloruro de carbono (CCl4), molécula estrictamente covalente, tiene un punto de fusión de 76,7 °C. Entre esas temperaturas se puede fijar arbitrariamente una línea de unos 300 °C para distinguir la mayoría de los compuestos covalentes de los iónicos.Gran parte de los compuestos orgánicos tienen los puntos de fusión y ebullición por debajo de los 300 °C, aunque existen excepciones.
Por lo general, los compuestos orgánicos se disuelven en disolventes no polares (líquidos sin carga eléctrica localizada) como el octano o el tetra cloruro de carbono, o en disolventes de baja polaridad, como los alcoholes, el ácido etanoico (ácido acético) y la propanona (acetona). Los compuestos orgánicos suelen ser insolubles en agua, un disolvente fuertemente polar.
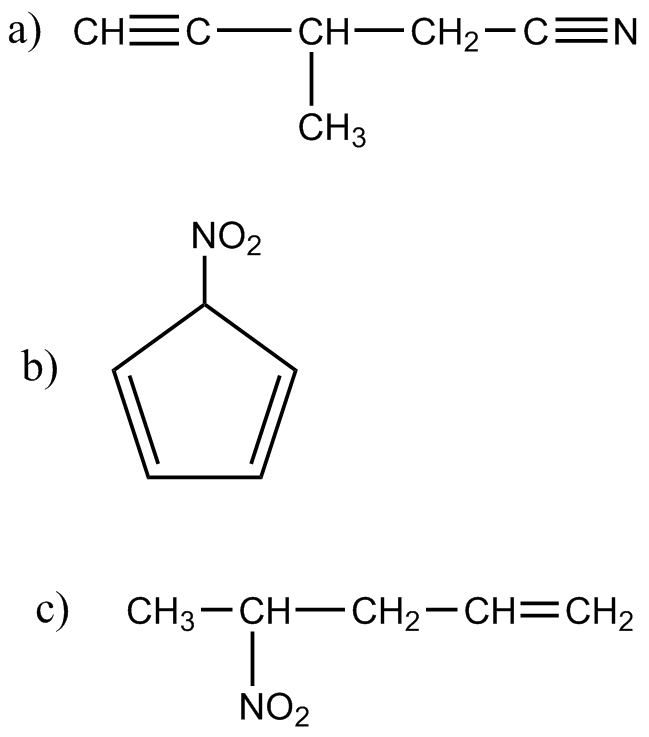
En ocasiones los
alcoholes poseen más de un grupo oxihidrilo (-OH) de aquí que, atendiendo a la
cantidad de grupos hidroxilo presentes en la molécula de un alcohol, éste se
clasifica como monohidroxilado, dihidroxilado o polihidroxilado.
Por otro lado, derivados
del alcohol o del agua estructuralmente pueden considerarse los éteres, en los
que se han reemplazado uno o dos hidrógenos, respectivamente, por restos
carbonados.
os compuestos que
contienen un grupo funcional se nombran siguiendo lo expresado para los
alcanos, pero en este caso se debe tener en cuenta que la cadena principal debe
contener el grupo funcional y éste determina el sufijo del compuesto. Además,
debe enumerarse de tal forma que el grupo reciba el índice más bajo posible.
La cantidad de átomos de
carbono que constituye la cadena principal y el grupo funcional que identifica
a los alcoholes, así como la terminación ol que los identifica, es importante
para nombrarlos correctamente.
De acuerdo a la
estructura que presenta los alcoholes y los éteres, así serán las propiedades
que muestran estos compuestos orgánicos oxigenados.
Dentro de las
principales propiedades físicas que manifiestan los alcoholes está su olor
característico, su estado de agregación (a 25ºC) variable, ya
que los alcoholes desde un átomo de carbono a cuatro, son líquidos solubles
totalmente en agua; desde cinco átomos de carbono a carbono doce, son líquidos
aceitosos, no son tan solubles en agua, los de más de doce átomos de
carbono son sólidos insolubles en agua. La solubilidad disminuye con el aumento
de la masa molar. Presentan además entre sus moléculas enlaces por puente de
hidrógeno de forma semejante al agua. Estas interacciones, le confieren a los
alcoholes temperaturas de fusión y ebullición mucho más elevadas que las de los
hidrocarburos de masa molar semejante y son responsables de muchas de las
propiedades de los alcoholes.
Los polioles o alcoholes
polihidroxilados poseen mayor temperatura de ebullición que los monoles con
igual número de carbonos ya que presentan masas molares mayores y tienen más
puntos de contacto para establecer enlaces por puente de hidrógeno.
Por su parte los
éteres están relacionados de manera estrecha con los alcoholes, la
mayoría son solubles en alcoholes y otros disolventes orgánicos, se
presentan como líquidos volátiles, ligeros e inflamables, no pueden
establecer enlaces de hidrógeno consigo mismos y sus temperaturas de
ebullición y fusión son muchos más bajos que los alcoholes de masa molar
semejante.
Sabías que para nombrar
a los alcoholes se utiliza muchas veces nombres triviales, por ejemplo el
etanol se conoce como alcohol etílico o simplemente alcohol, el metanol es
conocido como alcohol de madera, el etanodiol se conoce como glicol y el
propanotriol como glicerina.
Los alcoholes y los
éteres presentan isomería.
Los alcoholes monohidroxilados presentan los tres tipos de isomería
estructural, es decir, de cadena,
de posición y
de función.
Mientras que los éteres poseen isomería de cadena y de función.
En todos los compuestos
orgánicos se manifiesta la isomería de cadena, no sucede lo mismo con la
isomería de posición que no es posible en los aldehídos ni ácidos por
encontrarse en un carbono terminal su grupo funcional. En el caso de la
isomería de función sólo es posible entre los alcoholes con los éteres y los
aldehídos con las cetonas.
La presencia del grupo
funcional que caracteriza a cada una de estas sustancias establece que estos
compuestos manifiesten determinadas propiedades.
El grupo carbonilo es
muy polar de manera que la mayor parte de los aldehídos y cetonas son más
solubles en agua que los correspondientes hidrocarburos análogos. De hecho,
tanto la propanona (acetona) como el etanal (acetaldehído) son miscibles con
agua.
Los aldehídos y las
cetonas de bajas masas molares son apreciablemente solubles en agua, debido a
los enlaces por puente de hidrógeno que sus moléculas pueden formar con las de
dicho disolvente.
Sin embargo, a medida
que aumenta el número de átomos de carbono en la cadena carbonada unida al
grupo carbonilo, disminuye la solubilidad en agua, porque la poca polaridad de
esta cadena predomina con respecto a la parte polar de la molécula.
Los aldehídos y las
cetonas al ser sustancias polares, presentan temperaturas de ebullición más
elevadas que los compuestos no polares de masa molar semejante. No pueden
formar “enlaces por puente de hidrógeno” intermoleculares, pues no tienen un
átomo de hidrógeno unido a un átomo muy electronegativo como es el caso del
átomo de oxígeno en los alcoholes.
VIDEO
HAOLOGENO
(COMPUESTO ORGANICO )
son un grupo de elementos que se encuentran ubicados en grupo 17 de la tabla periódica. El grupo se encuentra formado por los elementos flúor, cloro, bromo, yodo y astato. También son conocidos como formadores de sales.
Los halógenos en estado natural se encuentran siempre como una molécula diatómica, que necesitan un electrón, por lo cual presentan una gran tendencia a combinarse y formar un ion negativo, conocido como haluro.
Los compuestos halogenados son compuestos ya sean sintéticos o naturales, que en su composición participa algún elemento halógeno. Si los halógenos se unen con elementos metálicos, forman sales halogenadas, como por ejemplo, los cloruros, yoduros, fluoruros, y bromuros. También se combinan con el hidrógeno formando ácidos, y con el oxígeno más un elemento metálico.
Los halógenos tienen la propiedad de poder formar, cuando se combinan con el sodio, sales parecidas a la sal común.
Todos los elementos del grupo 17 poseen valencia -1, combinándose con metales, consiguiendo la formación de halogenuros (o haluros), y también con metales y no metales formando iones de tipo complejo. Los primeros cuatro elementos del grupo de los halógenos, se combinan fácilmente con los hidrocarburos, dando los compuestos que se conocen como halogenuros de alquilo.
Haluros:
Son compuestos binarios formados por un halógeno y un elemento menos electronegativo. Dependiendo que halógeno sea, los haluros podrán ser fluoruro, cloruro, bromuro o yoduro:
Fluoruros:
Son sales derivadas del ácido fluorhídrico (HF). Todos los fluoruros son compuestos sin color generalmente, siendo solubles en agua en el caso de estar formados por metales alcalinos, y poco solubles en el caso de encontrarse formados por elementos alcalinotérreos. Estos se encuentran presentes en minerales, como es el caso de la fluorita.
Estos compuestos suelen utilizarse en la higiene buco dental, donde gracias a que el flúor cambia grupos hidróxido del esmalte de los dientes, hace que éstos sean más resistentes contra las caries. Los fluoruros suelen encontrarse presentes en pastas de dientes.
Cloruros:
Los cloruros son compuestos que en su composición tienes cloro en su estado de oxidación más bajo, es decir -1. En el caso de los cloruros orgánicos, el cloro se encuentra unido al carbono de manera directa, pudiendo ser sustituido el cloro fácilmente por otros elementos debido a la fuerte diferencia de electronegatividad entre los átomos que conforman el compuesto. Dichas sustituciones se conocen con el nombre de sustituciones nucleofílicas. En el caso de los cloruros inorgánicos, son compuestos que contienen un anión Cl^-1 en su composición por lo cual se dice que proceden del ácido clorhídrico (HCl).
En general suelen ser bastante solubles en agua, con algunas excepciones.
El cloruro más famoso es sin duda la sal presente en el agua de mar, siendo los mares y océanos fuentes inagotables de cloruros.

El análisis de
Compuestos Orgánicos Halogenados provenientes de biogás y gas natural
esencialmente son de tipo Freones y en nuestros laboratorios se determinan
mediante la técnica GC-ECD, la cual por excelencia muestra los mejores niveles
de sensibilidad para este grupo de analitos. Este método permite detectar desde
niveles ppbv hasta ppmv en muestras de Biogas, Gas Natural y relacionados.
Debido a la nube
electrónica característica de los átomos halogenados que poseen estos
compuestos, el detector ECD (Electron Capture Detector) constituye un sistema
de detección muy sensible para estas moléculas. Los componentes halogenados
presentes en el Biogas y matrices similares son especies volátiles tipo
freones, con una gran diversidad de combinaciones generalmente de átomos de
Flúor y Cloro en sus moléculas. Nuestro departamento de Servicios Analíticos
brinda la posibilidad de determinar el contenido de compuestos halogenados
totales así como el contenido de átomos de F, Cl, Br y I en la mezcla gaseosa.
Los derivados
halogenados o halogenuros de alquilo, derivan de los hidrocarburos, en los que
uno o más hidrógenos se sustituyen por halógenos, el átomo de halógeno presente
en la estructura está unido por un enlace covalente a un átomo de carbono con
hibridación sp3. Su fórmula general es R-X, donde X puede ser cualquier
halógeno: -F, -Cl, -Br, -I. Se nombran de acuerdo a las reglas IUPAC de los
alcanos, el halógeno se considera un sustituyente más de la cadena principal, los
derivados halogenados sencillos reciben nombres triviales como haluros de
alquilo, es decir se emplea el nombre del anión (cloruro, fluoruro, Ioduro,
Bromuro) seguido del nombre del grupo alquilo correspondiente.
De las propiedades
físicas de los derivados halogenados se tienen puntos de ebullición mayores que
los alcanos con el mismo número de carbonos aumentando con la masa atómica del
halógeno, a pesar de su polaridad son insolubles en agua pero pueden disolverse
en disolventes no polares como el tetracloruro de carbono, éter de petróleo y
benceno, su densidad se mide en función al peso atómico del halógeno, siendo
los derivados monofluorados y monoclorados menos densos que el agua. Los
derivados halogenados participan en reacciones de sustitución que permiten
obtener con cierta facilidad otros compuestos orgánicos importantes, tales como
alcoholes, éteres, alcanos, etc. Los derivados halogenados se emplean como
disolventes industriales, anestésicos o antisépticos en medicina, fabricación
de extintores de incendios, insecticidas, polímeros fluorados como el teflón,
refrigerantes y propelentes. Algunos derivados halogenados, los fluidos de
sistemas refrigerantes y aerosoles, conocidos como freones, los Cloro Fluoro
carbonos (CFC) causan un daño ambiental destruyendo la capa de ozono.
VIDEO
WEBGRAFIA
- https://www.ecured.cu/Compuesto_org%C3%A1nico
-http://auraieta.blogspot.com/
-https://www.aguamarket.com/diccionario/terminos.asp?Id=1272
-https://es.scribd.com/doc/69895836/Compuestos-Organicos-Del-Nitrogeno
-https://www.monografias.com/trabajos91/los-compuestos-organicos/los-compuestos-organicos.shtml
-https://quimica.laguia2000.com/general/compuestos-halogenados
- http://www.prtr-es.es/Compuestos-Organicos-Halogenados-AOX,15627,11,2007.html



JUEGO NO SE VEN BIEN LAS IMÁGENES DE LOS COMPUESTOS 4,0
ResponderEliminarGRUPOS LE FALTÓ MUCHA CONSULTA 3,0
DEFINITIVA