BLOG DE QUIMICA
MICHELLE JULIANA SANDOVAL ARIZA
Consulta y ejercicios de neutralizacion, ph y titulacion
ESP. DIANA FERNANDA JARAMILLO
INSTITUCION EDUCATIVA EXALUMNAS DE LA PRESENTACION
AREA: EDUCACION AMBIENTAL
IBAGUE
2018
INTRODUCCIÓN
Este informe tiene como finalidad instruir a la audiencia acerca de la neutralizacion, PH e indicadores y Titulación. Se hablara de distintos temas y en su marco teórico se lograra adquirir nuevos conocimientos, finalmente se pondrá en practica con la realización de ejercicios y ejemplos desarrollados en la plataforma YENKA.
OBJETIVOS
- Permitir que el estudiante aprenda de una forma didáctica y entretenida temas como PH e indicadores, neutralizacion y titulación, con su respectiva practica.
- Familiarizar al estudiante con los diferentes temas a conocer, para que los pueda aplicar, comprender y se facilite su realización.
- Identificar cada tema, sus características, formulas, procedimiento, etc.
NEUTRALIZACIÒN
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua.La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua.
La ecuación general que representa este tipo de reacción es:
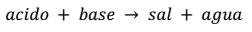
Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
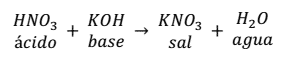
Como se puede observar en la reacción, la sal se forma entre el anión (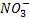 ) del ácido y el catión (K+).
) del ácido y el catión (K+).
Otra reacción de neutralización es la que se produce entre el ácido sulfúrico y el hidróxido de sodio.
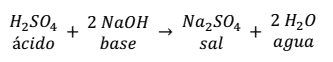
Como se puede observar en la reacción, la sal se forma entre el anión (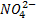 ) del ácido con 2 cationes (Na+) de labase, más 2 moléculas de agua.
) del ácido con 2 cationes (Na+) de labase, más 2 moléculas de agua.
La variación de entalpia (∆H) en las reacciones de neutralización entre ácidos fuertes y bases fuertes, es siempre la misma.
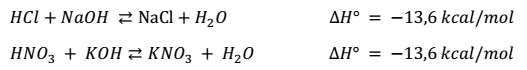
- La neutralización es la combinación de cationes hidrogeno y de aniones hidróxido para formar moléculas de agua.
- Se le conoce también como la reacción química formada de un ácido con una base.
- Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
- En una reacción química; cuerpos o sustancias experimentan transformaciones que alteran su composición dando origen a: sustancias nuevas.
- Cambios en sus propiedades.
- Las que experimentan cambios se denominan reactivos y los que se forman productos.
- De la reacción química formado por un ácido base se obtienen compuestos llamados sales.
EJERCICIOS DE YENKA :
1)
La primera base seccionada: Hidróxido de Potasio (KOH)
Hidróxido de Potasio
Ácido seleccionado: Ácido Nítrico (HNO3)
Reacción: HNO3 + KOH ---- H2O + KNO3
2.
Base seleccionada: Hidróxido de Sodio (NaOH)
Hidróxido de Sodio
 Ácido seleccionado: Ácido Clorhidrico (HCL)
Ácido seleccionado: Ácido Clorhidrico (HCL)  Reacción: HCL + NaOH ---- H2O + NaCL
Reacción: HCL + NaOH ---- H2O + NaCL
3.
 La primera base seccionada: Hidróxido de Potasio (KOH)
La primera base seccionada: Hidróxido de Potasio (KOH)
Hidróxido de Potasio
Ácido seleccionado: Ácido Sulfurico (H2SO4)
Reacción: H2SO4 + KOH ---- H2O + K2SO4
4.
Base seleccionada: Hidróxido de Sodio (NaOH)
Hidróxido de Sodio
Reacción: HNO3 + NaOH ---- H2O + NaNO3
15
PH E INDICADORES
Los indicadores son colorantes orgánicos, que experimentan una variación de color que se puede observar en una escala numérica llamada escala pH. Según estén en presencia de una sustancia ácida o básica el color es de un tono determinado.

En el mercado existen distintas herramientas para medir el potencial de hidrogeno de alimentos, medicamentos y sustancias químicas; cada herramienta cumple con la finalidad necesaria, pero sus aplicaciones y los medios en donde se utilizan son distintos. En las industrias alimenticias o en otros ramos se suele utilizar un indicador de pH, que es una sustancia química que cambia de color cuando la disolución modifica su pH dentro de cierto rango.
El cambio de color del indicador se debe a que al aumentar o disminuir la acidez o alcalinidad de la disolución, se genera un cambio químico estructural que hace que el numero de protones del elemento aumenten o disminuyan. Estos indicadores también suelen ser llamados indicadores ácido-base y tienen un viraje de una unidad arriba y otra abajo de pH. Los más conocidos son: el naranja de metilo, que vira en un intervalo de pH 3, 1-4, 4, de color rojo a naranja y la fenolftaleína, que vira desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados / violetas.
Cuando mencionamos este concepto, nos tamos refiriendo a un tipo de medida de la alcalinidad y la acidez de algún tipo de solución existente.
- La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
- Su principal función y prioridad es la del medir con la mayor exactitud el número de iones de hidrogeno existentes dentro de la solución con la que estamos trabajando.
- Cuando requerimos conocer el PH de alguna solución, lo que necesitamos es hacer uso de los indicadores de PH, que es en realidad una sustancia la cual nos permitirá llevar una medición de alguna solución.
* Su principal característica es la de generar un cambio en el color de la sustancia, que pueden ir de un color a otro o de ser incoloro a adquirir una nueva tonalidad. Este cambio se lleva a cabo como consecuencia de las alteraciones estructurales brindadas por la adición de un protón (H+), el proceso mencionado recibe el nombre de protonación.
Cuando mencionamos este concepto, nos tamos refiriendo a un tipo de medida de la alcalinidad y la acidez de algún tipo de solución existente.
- La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
- Su principal función y prioridad es la del medir con la mayor exactitud el número de iones de hidrogeno existentes dentro de la solución con la que estamos trabajando.
- Cuando requerimos conocer el PH de alguna solución, lo que necesitamos es hacer uso de los indicadores de PH, que es en realidad una sustancia la cual nos permitirá llevar una medición de alguna solución.
* Su principal característica es la de generar un cambio en el color de la sustancia, que pueden ir de un color a otro o de ser incoloro a adquirir una nueva tonalidad. Este cambio se lleva a cabo como consecuencia de las alteraciones estructurales brindadas por la adición de un protón (H+), el proceso mencionado recibe el nombre de protonación.
¿Cómo funciona un indicador?
Los indicadores presentan un comportamiento muy sencillo. Estos elementos se constituyen de una forma ácida o una forma básica débil con una forma general. Al estar en las sustancias, si se ioniza por un aumento o disminución de los ácidos o las bases, se desencadenará una reacción creando una forma conjugada produciendo un nuevo elemento que tiñe las disoluciones.
Una característica de los indicadores es que la forma ácida y la forma básica, tienen colores diferentes, los más comunes son el amarillo para ácidos y el azul para bases (alcaloides). Aunque el color final depende de las cantidades de una u otra forma que se encuentren presentes en la disolución.
A) TORNASOL
El Papel tornasol o Papel pH es utilizado para medir la concentración de Iones Hidrogenos contenido en una sustancia o disolución. Mediante la escala de pH, la cual es clasificada en distintos colores y tipos.
El papel tornasol se sumerge en soluciones y luego se retira para su comparación con la escala de pH.
B) FENOLFTALEINA
Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.
C) UNIVERSAL
es una herramienta que se utiliza en laboratorio para realizar montajes con los materiales presentes en el laboratorio permitiendo obtener sistemas de medición y preparar diversos experimentos.
VIDEO :
TITULACIÓN
La titulación es un procedimiento cuantitativo analítico de la química. Con la titulacion puede determinar la concentración desconocida en un líquido añadiéndole reactivos de un contenido conocido. La titulación es un procedimiento relativamente sencillo que no requiere un despliegue de aparatos técnicos para determinar la concentración de sustancias conocidas disueltas.
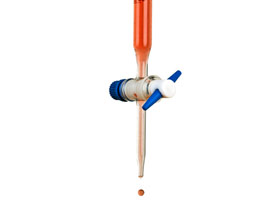
Los instrumentos esenciales para la titulacion son una bureta y un vaso de precipitados. La bureta contiene una solución volumétrica de la cual se conoce la concentración de la sustancia. En el vaso de precipitados se encuentra la solución con la concentración desconocida y un indicador para la detección del parámetro. Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el consumo de la solución volumétrica, calcular la concentración de la solución con la muestra.
Los diferentes procedimientos de titulación se pueden separar según los tipos de reacción químicos. Por ejemplo, existe la titulación ácido-base, la titulación redox o la titulación por precipitación. La titulación es aplicada en muchos ámbitos: En el análisis medioambiental, en el control de procesos, en el análisis farmacológico y forense, en el análisis de alimentos o también en la investigación.
1)
2)
3)
4)
5)
6)


























No hay comentarios:
Publicar un comentario