REACCIÓN QUÍMICA
Las reacciones químicas suceden cuando se rompen o se forman enlaces químicos entre los átomos. Las sustancias que participan en una reacción química se conocen como los reactivos, y las sustancias que se producen al final de la reacción se conocen como los productos. Se dibuja una flecha entre los reactivos y los productos para indicar la dirección de la reacción química, aunque una reacción química no siempre es una "vía de un solo sentido", como veremos más adelante en la siguiente sección.
Por ejemplo, la reacción de descomposición del peróxido de hidrógeno (H, start subscript, 2, end subscriptO, start subscript, 2, end subscript) en agua y oxígeno se puede escribir de la siguiente manera:
2, H, start subscript, 2, end subscript right arrow 2, H, start subscript, 2, end subscript, O, left parenthesis, a, g, u, a, right parenthesis +
En este ejemplo, el peróxido de hidrógeno es nuestro reactivo, y se descompone en agua y oxígeno, nuestros productos. Los átomos que comenzaron en las moléculas de peróxido de hidrógeno se re acomodaron para formar moléculas de agua (H, start subscript, 2, end subscript, O) y oxígeno (O, start subscript, 2, end subscript).

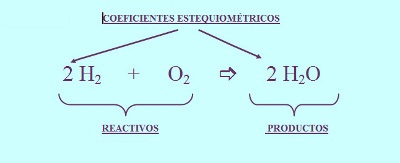
Tal vez hayas notado los números adicionales en la reacción química anterior: el 2 en frente del peróxido de hidrógeno y el agua. Estos números se llaman coeficientes y nos dicen cuánto de cada molécula participa en la reacción. Se deben incluir con el fin de que nuestra ecuación esté balanceada, es decir que el número de átomos de cada elemento sea igual en los dos lados de la ecuación.
Las ecuaciones deben estar balanceadas para reflejar la ley de la conservación de la materia, que dice que no se crean ni se destruyen átomos durante el curso de una reacción química normal.

ECUACIÓN QUÍMICA
si ponemos en contacto gas oxígeno y gas hidrógeno en las condiciones adecuadas reaccionarán para dar agua líquida. En este ejemplo el oxígeno y el hidrógeno, que son las sustancias que hay inicialmente y que van a "desaparecer" decimos que son las sustancias que reaccionan o los reactivos y el agua que es la nueva sustancia, la que "aparece", decimos que es el producto.
También sabes que los químicos utilizan símbolos para simplificar los nombres de las sustancias puras, las fórmulas químicas. De la misma manera en lugar de describir las reacciones químicas con palabras como he hecho en el ejemplo anterior lo hacen de manera simbólica en lo que se conoce como ecuación química. La ecuación química de nuestra reacción entre el oxígeno y el hidrógeno es:
También sabes que los químicos utilizan símbolos para simplificar los nombres de las sustancias puras, las fórmulas químicas. De la misma manera en lugar de describir las reacciones químicas con palabras como he hecho en el ejemplo anterior lo hacen de manera simbólica en lo que se conoce como ecuación química. La ecuación química de nuestra reacción entre el oxígeno y el hidrógeno es:
H2 (g) + O2 (g) e H2O (l)
es un enunciado que utiliza fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en una reacción química.Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.
COMO SE ESCRIBE UNA ECUACIÓN QUÍMICA
Una ecuación química usa los símbolos y fórmulas de los reactivos y productos, y otros términos simbólicos para representar una reacción química. Las ecuaciones se escriben siguiendo los siguientes pasos:
1)Los reactivos se separan de los productos con una flecha (  ) que indica el sentido de la reacción. Una flecha doble (
) que indica el sentido de la reacción. Una flecha doble (  ) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
2) Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
3) Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula ( ) colocada sobre la flecha (
) colocada sobre la flecha ( ) indica que se suministra calor a la reacción.
) indica que se suministra calor a la reacción.
4) Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
5) El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
6) Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
7) Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
8) Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
9) Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
10) Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
ejemplo :
* 
* 
* 
CLASES DE REACCIÓN QUÍMICA
REDACCIÓN DE SÍNTESIS O COMBINACIÓN :
Se presentan cuando se unen dos o mas sustancias para formar otra sustancia, cuyas moléculas son el resultado de una re agrupación de átomos de los reactivos.
Es así que A +B → AB
Un ejemplo de esta reacción es la combinación de hidrógeno con oxígeno para producir agua:
2H2 + O2 → 2H2O
Un ejemplo de esta reacción es la combinación de hidrógeno con oxígeno para producir agua:
2H2 + O2 → 2H2O
DESCOMPOSICIÓN :
Ocurre cuando a partir de un compuesto se producen dos o mas sustancias.
AB → A + B
Como ejemplo tomamos a el carbonato de calcio que se descompone por medio de calentamiento
para producir oxido de calcio y dióxido de carbono.
CaCo3 → CaO + CO2
DESPLAZAMIENTO O SUSTITUCIÓN :
En estas reacciones, un elemento sustituye y libera a otro elemento presente en el compuesto.
En este tipo se da que:
A + BC → AC + B
*Ejemplo:
El bromo líquido, que desplaza al yodo en el yoduro de sodio para producir bromuro de sodio dejando al yodo libre.
2NaI + Br2 → 2NaBr + I2
INTERCAMBIO
Al reaccionar dos compuestos estos intercambian sus elementos y se producen dos nuevos compuestos.
Se representa de esta manera:
AB + CD → AC + BD
*Ejemplo:
La combinación del ácido clorhídrico con el hidróxido de sodio y el agua.(neutralización)
HCl + NaOH → NaCl + H2O